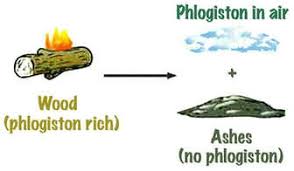
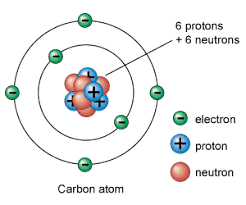
قانون بقای جرم (Conservation of mass / matter) یکی از اصول اساسی در علم شیمی و فیزیک است که بیان میکند: در یک واکنش شیمیایی، جرم کل مواد قبل و بعد از واکنش تغییر نمیکند. به عبارت دیگر، جرم ماده در یک سیستم بسته حفظ میشود و هیچگاه از بین نمیرود و یا به صورت ناگهانی ایجاد نمیشود. این قانون اولین بار توسط آنتوان لاووازیه (Antoine Lavoisier) در اواخر قرن هجدهم معرفی شد.
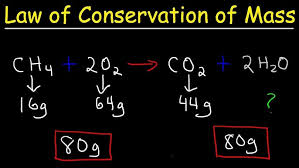
1. تعریف و توضیح قانون
در یک واکنش شیمیایی، اگر تمام واکنشدهندهها و محصولات واکنش را بررسی کنیم، مجموع جرمهای واکنشدهندهها قبل از واکنش با مجموع جرمهای محصولات بعد از واکنش برابر است. به عبارت دیگر، مواد وارد شده به واکنش، به مواد جدیدی تبدیل میشوند، اما جرم کل سیستم ثابت میماند.