الکترون یک ذره subatomic است که جزء اصلی و بنیادی اتمها به شمار میآید. این ذره بار منفی (Negative charge) دارد و یکی از اجزای اصلی اتمها به شمار میآید، که به همراه پروتونها و نوترونها تشکیلدهنده ساختار اتمی هستند.
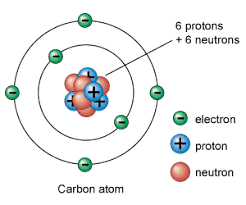
ویژگیهای کلیدی الکترون:
-
بار الکتریکی (Electric charge):
- الکترون دارای بار منفی است. مقدار بار الکترون معادل ۱.۶ × ۱۰⁻¹⁹ کولن (Coulomb) است.
-
جرم (Mass):
- جرم الکترون بسیار کوچک است. جرم تقریبی الکترون برابر با 9.11 × 10⁻³¹ کیلوگرم است که تقریباً ۱۸۳۶ بار کمتر از جرم یک پروتون یا نوترون است.
-
چرخش یا اسپین (Spin):
- الکترونها دارای ویژگیای به نام اسپین هستند که به نوعی رفتار چرخشی ذره در فضا را توضیح میدهد. اسپین الکترون مقدار 1/2 دارد که نشاندهنده خاصیت کوانتومی این ذره است.
-
موقعیت در اتم (Position in Atom):
- الکترونها در مناطق خاصی به نام مدارها (Orbitals) در اطراف هسته اتم قرار دارند. این مدارها میزان انرژی مختلفی دارند که به آنها سطوح انرژی (Energy levels) گفته میشود.
-
موجی-ذرهای بودن (Wave-Particle Duality):
- الکترونها خاصیت دوگانه دارند به این معنی که هم رفتار ذرهای (Particle behavior) و هم رفتار موجی (Wave behavior) از خود نشان میدهند. این ویژگی در تئوری مکانیک کوانتومی (Quantum Mechanics) به وضوح توضیح داده شده است.
تاریخچه کشف الکترون:
الکترون برای اولین بار توسط فیزیکدان انگلیسی، جوزف جان تامسون (J.J. Thomson) در سال ۱۸۹۷ کشف شد. تامسون این کشف را از طریق آزمایشاتی که با لامپهای تخلیه گازی انجام داد، به دست آورد. او متوجه شد که جریان الکتریکی میتواند به ذرات کوچکی تبدیل شود که خاصیت منفی دارند، که به نام الکترون شناخته شد.
نقش الکترونها در اتمها:
الکترونها در تعیین ویژگیهای شیمیایی اتمها نقش حیاتی دارند. این ذرات مسئول تشکیل پیوندهای شیمیایی بین اتمها هستند و تعاملات الکترونی اساس بسیاری از واکنشهای شیمیایی را تشکیل میدهند.
- در پیوند کووالانسی (Covalent bond) الکترونها به اشتراک گذاشته میشوند.
- در پیوند یونی (Ionic bond) الکترونها بین دو اتم منتقل میشوند.
انرژی و موقعیت الکترونها:
الکترونها در یک اتم، بر اساس اصول مکانیک کوانتومی (Quantum mechanics principles)، میتوانند تنها در سطوح انرژی معینی قرار گیرند. هر سطح انرژی به یک مدار کوانتومی (Quantum orbital) اختصاص دارد و الکترونها نمیتوانند در موقعیتهایی با انرژیهای بین این سطوح قرار گیرند.
مدلهای مختلف اتمی:
در طول تاریخ، مدلهای مختلفی برای توصیف رفتار الکترونها و ساختار اتم توسعه یافتهاند:
- مدل اتمی تامسون (Thomson's Atomic Model): که الکترونها را مانند کشمشهای پراکنده در یک دسر باردار مثبت در نظر میگرفت.
- مدل اتمی رادرفورد (Rutherford's Atomic Model): که هستهای مثبت را در مرکز اتم فرض میکرد و الکترونها را در اطراف آن میچرخاند.
- مدل اتمی بور (Bohr's Atomic Model): که برای اولین بار اجازه میداد الکترونها در مدارهایی با انرژیهای گسسته (Discrete energy levels) قرار گیرند.
الکترونها و جریان الکتریکی:
الکترونها در جریان الکتریکی (Electric current) نقش اصلی دارند. زمانی که الکترونها از یک محل به محل دیگر حرکت میکنند، جریان الکتریکی ایجاد میشود. این حرکت به ویژه در مواد رسانا مانند مس (Copper) یا آلومینیوم (Aluminum) مشاهده میشود.
کشف و کاربردها:
- الکترونها در بسیاری از فناوریهای مدرن مانند ترانزیستورها، مدارهای مجتمع، صفحهنمایشهای الکترونیکی و لیزرها کاربرد دارند.
- فناوریهایی مانند پرتوسازی الکترون (Electron microscopy) و پرتوشناسی الکترون (Electron beam tomography) برای مشاهده ساختارهای میکروسکوپی از الکترونها استفاده میکنند.
نتیجهگیری:
الکترونها ذرات بنیادی هستند که ویژگیهای پیچیده و شگفتانگیزی دارند. آنها نقش مهمی در ساختار اتمها و همچنین در بسیاری از فرآیندهای فیزیکی و شیمیایی ایفا میکنند. از کشف الکترونها تاکنون، فهم ما از طبیعت مواد و پدیدههای فیزیکی بهطور چشمگیری بهبود یافته است.

