قانون بقای جرم (Conservation of mass / matter) یکی از اصول اساسی در علم شیمی و فیزیک است که بیان میکند: در یک واکنش شیمیایی، جرم کل مواد قبل و بعد از واکنش تغییر نمیکند. به عبارت دیگر، جرم ماده در یک سیستم بسته حفظ میشود و هیچگاه از بین نمیرود و یا به صورت ناگهانی ایجاد نمیشود. این قانون اولین بار توسط آنتوان لاووازیه (Antoine Lavoisier) در اواخر قرن هجدهم معرفی شد.
1. تعریف و توضیح قانون
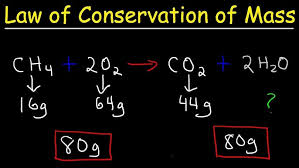
در یک واکنش شیمیایی، اگر تمام واکنشدهندهها و محصولات واکنش را بررسی کنیم، مجموع جرمهای واکنشدهندهها قبل از واکنش با مجموع جرمهای محصولات بعد از واکنش برابر است. به عبارت دیگر، مواد وارد شده به واکنش، به مواد جدیدی تبدیل میشوند، اما جرم کل سیستم ثابت میماند.
2. تاریخچه
قانون بقای جرم در قرن هجدهم توسط آنتوان لاووازیه شواهد علمی خود را پیدا کرد. او آزمایشهایی انجام داد که نشان داد جرم مواد در هنگام سوختن تغییر نمیکند. در یکی از مشهورترین آزمایشهای خود، لاووازیه سوختن فسفر را در ظرف بسته انجام داد و مشاهده کرد که جرم ظرف قبل و بعد از سوختن همانطور که انتظار میرفت ثابت مانده است. او از این آزمایشها به این نتیجه رسید که جرم مواد نه از بین میرود و نه به طور ناگهانی تولید میشود، بلکه فقط از شکلی به شکل دیگر تبدیل میشود.
3. نحوه آزمایش بقای جرم
برای درک این قانون، میتوان واکنشهای شیمیایی مختلفی را بررسی کرد:
سوختن چوب: وقتی چوب میسوزد، به نظر میرسد که چوب ناپدید میشود. اما در حقیقت، چوب به ترکیبات دیگری تبدیل میشود (دوده، گازهای مختلف و خاکستر). اگر همه مواد تولیدی را جمعآوری کنید، مجموع جرم این مواد معادل جرم اولیه چوب خواهد بود.
واکنش بین اسید و باز: اگر اسید و باز با یکدیگر واکنش دهند، هیچگاه جرم آنها از بین نمیرود. مواد جدیدی که در این واکنش تولید میشوند، مانند آب و نمک، جرم مشابهی دارند.
4. پیامدهای علمی و کاربردهای قانون بقای جرم
شیمی کلاسیک: قانون بقای جرم مبنای بسیاری از واکنشهای شیمیایی و معادلات شیمیایی است. در تمامی واکنشها، وقتی معادله شیمیایی را مینویسیم، باید اطمینان حاصل کنیم که تعداد اتمها و جرمها در دو طرف معادله برابر باشد.
تعادل شیمیایی: در واکنشهای شیمیایی برگشتپذیر، قانون بقای جرم کمک میکند تا مواد در وضعیت تعادل باقی بمانند و جرم کلی ثابت بماند.
محاسبات شیمیایی: این قانون برای محاسبات مختلف شیمیایی، مانند تعیین میزان مواد مصرفی یا تولیدی در یک واکنش، اهمیت دارد. دانشمندان از این قانون برای تعیین مقادیر مواد در فرایندهای صنعتی استفاده میکنند.
5. محدودیتها و استثنائات
واکنشهای هستهای: در واکنشهای هستهای، که در آن تغییرات در هسته اتمها رخ میدهد، قانون بقای جرم به صورت دقیق برقرار نیست. در این واکنشها، جرم ممکن است کمی کاهش یابد و به انرژی تبدیل شود، طبق معادله مشهور اینشتین E=mc^2 در چنین واکنشهایی، انرژی و جرم به طور کلی حفظ میشوند، اما نه به صورت مستقیم و تنها در یک سیستم بسته.
فرایندهای فیزیکی: در برخی از فرایندهای فیزیکی، مانند انبساط یا انقباض گازها، جرم به طور محلی ممکن است تغییر کند، اما در سطح کل سیستم، باز هم قانون بقای جرم برقرار است.
6. نتیجهگیری
قانون بقای جرم، اساس علم شیمی را تشکیل میدهد و فهم این که جرم در واکنشهای شیمیایی حفظ میشود، به دانشمندان کمک کرده است تا درک بهتری از نحوه تعاملات ماده با یکدیگر پیدا کنند. این قانون همچنان یکی از مهمترین اصول در شیمی و فیزیک باقی مانده است، هرچند که در برخی از واکنشهای هستهای استثنائاتی برای آن وجود دار
